Регистрационный номер: ЛП-006598
Торговое название препарата: Визкью®
Международное непатентованное название (МНН): Бролуцизумаб
Лекарственная форма: раствор для внутриглазного введения
Состав: 1 мл раствора содержит:
Действубщее вещество: бролуцизумаб – 120 мг;
Вспомогательные вещества: сахароза, натрия цитрат, полисорбат 80, натрия гидроксид, вода для инъекций.
Описание: от бесцветного до слегка коричневато-желтого цвета, от прозрачного до слегка опалесцирующего раствор.
Фармакотерапевтическая группа: средства, препятствующие новообразованию сосудов.
Код ATX S01LA06
Фармакологические свойства
Механизм действия
Патологический ангиогенез в глазу и отек сетчатки связан с повышенной активизацией сигнального пути фактора роста эндотелия сосудов A (VEGF-A). Бролуцизумаб с высокой аффинностью связывается с различными изоформами VEGF-A (в частности с VEGF110, VEGF121 и VEGF165), тем самым препятствуя связыванию VEGF-A с его рецепторами VEGFR-1 и VEGFR-2. Подавляя связывание VEGF-A, бролуцизумаб угнетает пролиферацию эндотелиальных клеток, тем самым уменьшая патологическую неоваскуляризацию и снижая проницаемость сосудов.
Фармакодинамика
Неоваскулярная (влажная) форма возрастной макулодистрофии (нВМД) характеризуется наличием патологической хориоидальной неоваскуляризации (ХНВ). Экссудация крови и жидкости из хориоидальных неоваскулярных мембран (ХНМ) может вызывать утолщение или отек сетчатки и (или) суб/интраретинальное кровоизлияние, приводящие к снижению остроты зрения.
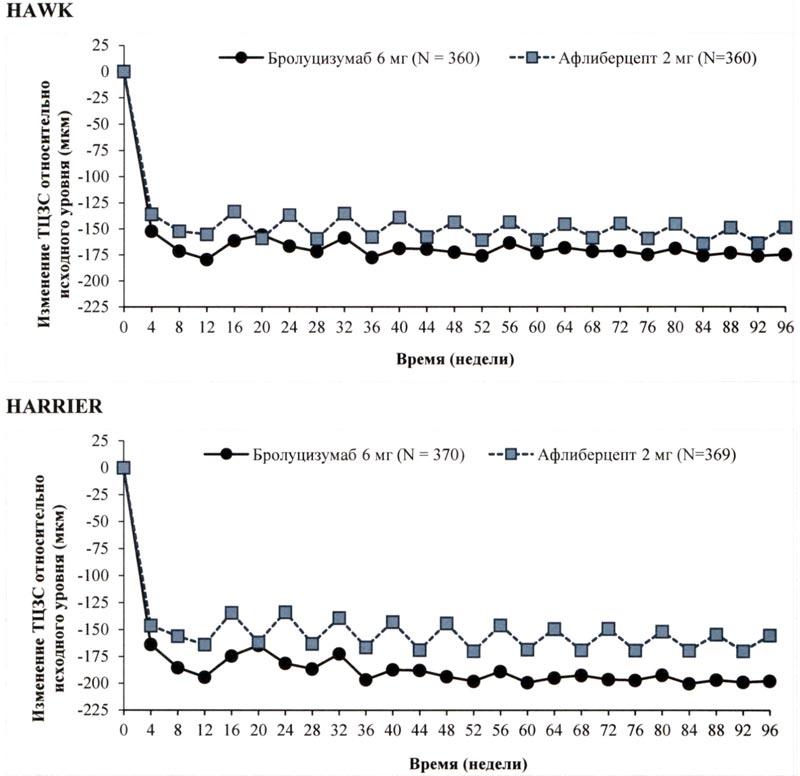
В исследованиях HAWK и HARRIER решение о лечении принималось на основании оценки активности заболевания, включающей оценку соответствующих анатомических параметров. У пациентов, получавших бролуцизумаб, уже через 4 недели после начала лечения и вплоть до 48 и 96 недель наблюдалось снижение толщины центральной зоны сетчатки (ТЦЗС) и количества интраретинальной/субретинальной жидкости (ИРЖ/СРЖ) или жидкости, находящейся под пигментным эпителием сетчатки (ПЭС). Снижение ТЦЗС и количества ИРЖ/СРЖ на 16 и 48 неделях в случае применения бролуцизумаба статистически значимо превышало соответствующее снижение в случае применения афлиберцепта (см. подраздел «Клиническая эффективность и безопасность»).
В этих исследованиях уменьшение размера очага ХНВ, у пациентов, получавших бролуцизумаб, наблюдалось уже через 12 недель и сохранялось через 48 и 96 недель после начала лечения.
Клиническая эффективность и безопасность
Безопасность и эффективность бролуцизумаба оценивали в 2 рандомизированных многоцентровых двойных слепых исследованиях III фазы с активным контролем (HAWK и HARRIER) у пациентов с нВМД. В этих исследованиях лечение в течение 2 лет получали в общей сложности 1817 пациентов (1088 – бролуцизумаб; 729 – афлиберцепт). Возраст пациентов варьировал от 50 до 97 лет; средний возраст составил 76 лет.
В исследовании HAWK пациентов рандомизировали в отношении 1:1:1 в группы со следующими схемами лечения:
бролуцизумаб 3 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В исследовании HARRIER пациентов рандомизировали в отношении 1:1 в группы со следующими схемами лечения:
бролуцизумаб 6 мг, применяемый каждые 12 или 8 недель (1 раз/12 нед/ 1 раз/8 нед) после 3 первых ежемесячных инъекций;
афлиберцепт 2 мг, применяемый каждые 8 недель (1 раз/8 нед) после 3 первых ежемесячных инъекций.
В обоих исследованиях пациенты из групп бролуцизумаба после 3 первых ежемесячных инъекций (0, 4 и 8 неделя), получали препарат каждые 12 недель с возможностью изменения интервала дозирования до 1 раза в 8 недель в зависимости от активности заболевания. Активность заболевания оценивал врач в первый 12-недельный интервал (на 16 и 20 неделях) и в каждый из последующих плановых визитов, в рамках которых проводились инъекции с интервалом 12 недель. Пациентам, у которых в какой-либо из этих визитов выявляли активность заболевания (например, снижение остроты зрения, увеличение толщины центральной зоны сетчатки (ТЦЗС) и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС)), интервал между инъекциями уменьшали до 1 раза в 8 недель.
Результаты
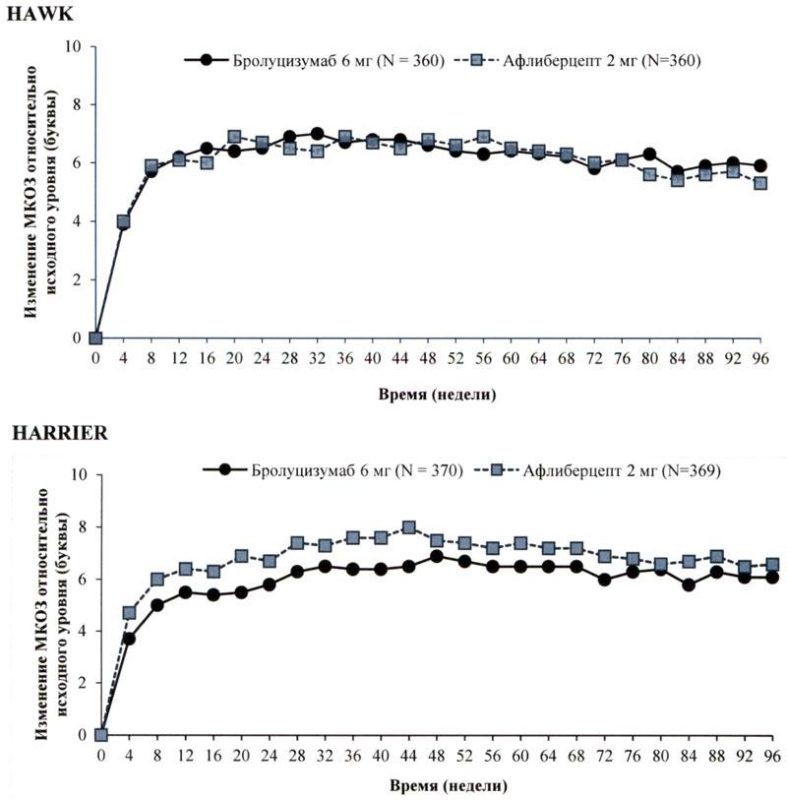
Первичной конечной точкой эффективности в обоих исследованиях являлось изменение относительно исходного уровня максимальной корригированной остроты зрения (МКОЗ) к 48 неделе, которую оценивали по буквенной шкале ETDRS (исследование «Лечение диабетической ретинопатии на ранней стадии»). Основная цель заключалась в демонстрации не меньшей эффективности бролуцизумаба по сравнению с афлиберцептом. В обоих исследованиях было показано, что бролуцизумаб (применяемый по схеме 1 раз/12 нед/ 1 раз/8 нед) по своей эффективности не уступает афлиберцепту 2 мг (применяемому по схеме 1 раз/8 нед). Увеличение остроты зрения, достигнутое в течение первого года, сохранялось и в течение второго года.
Результаты обоих исследований представлены в табл. 1 и на рисунке 1 ниже.
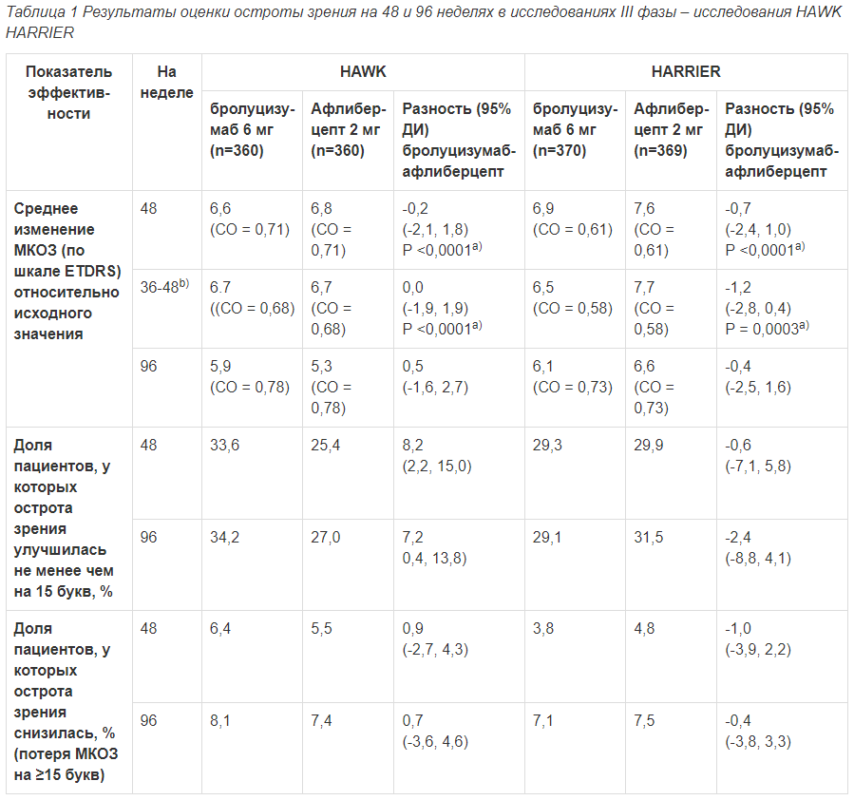
Таблица 1 Результаты оценки остроты зрения на 48 и 96 неделях в исследованиях III фазы – исследования НАWK HARRIER
МКОЗ: Острота зрения при максимальной коррекции; отсутствующие данные вменялись по методу переноса вперед последнего доступного наблюдения (LOCF)
ETDRS: Early Treatment of Diabetic Retinopathy Study / Исследование «Лечение диабетической ретинопатии на ранней стадии»
СО – стандартная ошибка, ДИ – доверительный интервал
a) Р-значение, относящееся к гипотезе о неменьшей эффективности с границей неменьшей эффективности 4,0 буквы
b) Ключевая вторичная конечная точка, учитывающая различия в схемах терапии бролуцизумабом и афлиберцептом
Рисунок 1 Среднее изменение остроты зрения от исходного уровня до 96 недели в исследованиях НАWK и HARRIER
На 48 неделе такое увеличение остроты зрения в исследованиях HAWK и HARRIER было достигнуто у 56% и 51% пациентов, получавших бролуцизумаб 6 мг каждые 12 недель соответственно, а на неделе 96 – у 45% и 39% пациентов. Среди пациентов, которые по результатам оценки, проведенной в первом 12-недельном интервале, соответствовали критериям продолжения инъекций с интервалом 1 раз/ 12 недель, 85% и 82% пациентов продолжали получать препарат каждые 12 недель вплоть до 48 недели. Из числа пациентов, получавших препарат с интервалом 12 недель на 48 неделе, 82% и 75% пациентов продолжали получать препарат каждые 12 недель вплоть до 96 недели.
Терапевтические эффекты в изученных подгруппах (например, различающихся по возрасту, полу, расе, исходной остроте зрения, исходной толщине сетчатки, типу и размеру очага ХНВ, статусу жидкости), в обоих исследованиях в целом соответствовали эффектам, наблюдаемым в общей популяции пациентов, включенных в данные исследования.
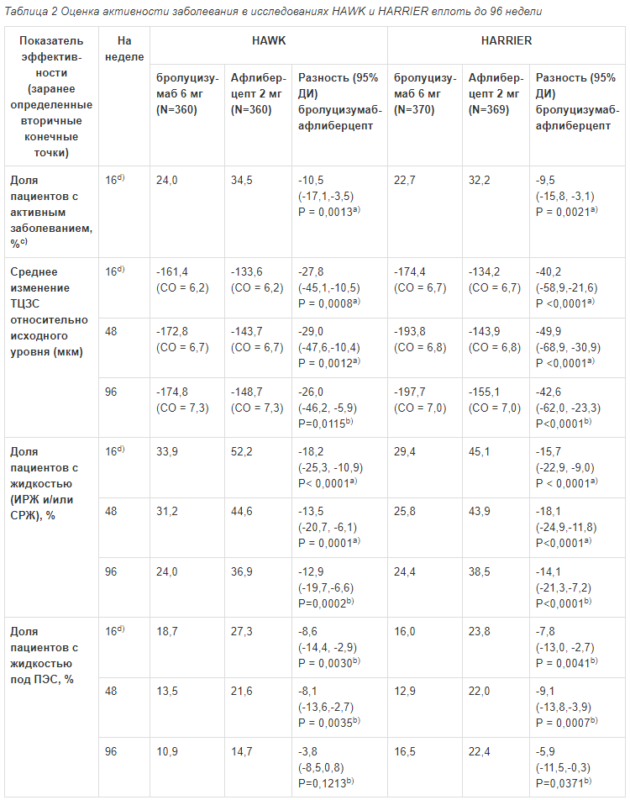
Активность заболевания оценивали по изменениям остроты зрения и (или) анатомических параметров, включающих ТЦЗС и (или) наличие жидкости в сетчатке (ИРЖ/СРЖ, жидкость под ПЭС). На 16 неделе, когда проводили первую оценку активности заболевания для определения интервала между инъекциями, доля пациентов с активным заболеванием в группе бролуцизумаба 6 мг оказалась статистически значимо ниже, чем в группе афлиберцепта 2 мг. В обоих исследованиях активность заболевания оценивали в течение всего исследования. Значения анатомических параметров, свидетельствующих об активности заболевания, на 48 неделе и на 96 неделе в группе бролуцизумаба были ниже, чем в группе афлиберцепта 2 мг (табл. 2).
Таблица 2 Оценка активности заболевания в исследованиях НАWK и HARRIER вплоть до 96 недели
ТЦЗС: Толщина центрального зоны сетчатки; ИРЖ/СРЖ: интраретинальная/субретинальная жидкость; ПЭС: пигментный эпителий сетчатки; СО: стандартная ошибка; ДИ – доверительный интервал.
a) Вторичная конечная точка в исследовании HARRIER, подтверждающий анализ в исследовании НАWK; 1-сторонние p-значения для оценки превосходства бролуцизумаба
b) Вторичные конечные точки в исследовании НАWK и HARRIER; 2-сторонние р-значения
c) Оценки активности заболевания были основаны на суждениях врача на 16 неделе, опирающихся на указания протокола: Снижение МКОЗ на ≥5 букв относительно исходного уровня, снижение МКОЗ на ≥3 буквы и увеличение ТЦЗС на ≥75 мкм по сравнению с неделей 12, снижение МКОЗ на ≥5 букв, обусловленное активностью неоваскулярной ВМД по сравнению с неделей 12 или вновь выявленные либо усугубившиеся интраретинальные кисты (ИРК)/ интраретинальная жидкость (ИРЖ) по сравнению с 12 неделей
d) До 16 недели оба препарата применяли с одинаковой частотой, что позволяет провести прямое сравнение бролуцизумаба и афлиберцепта
Рисунок 2 Изменение толщины центральной зоны сетчатки относительно исходного уровня до недели 96 в исследованиях НАWK и HARRIER
В обоих исследованиях применение бролуцизумаба приводило к клинически значимому улучшению относительно исходного уровня заранее определенной вторичной конечной точки эффективности, а именно исходов, оцениваемых самими пациентами по опроснику Национального института глаза для оценки зрительной функции (NEI VFQ-25). По величине эти изменения были примерно такими же, что и в ранее опубликованных исследованиях: МКОЗ увеличивалась на 15 букв. Улучшения, отмеченные пациентами, сохранялись и в течение второго года.
Клинически значимых различий между группами бролуцизумаба и афлиберцепта ни в изменениях общего показателя по шкале NEI VFQ-25, ни в изменениях показателей по отдельным подшкалам (зрение в целом, боль в глазу, зрение вблизь, зрение вдаль, социальное функционирование, психическое здоровье, ролевые трудности, зависимость, вождение автомобиля, цветное зрение и периферическое зрение) к 48 неделе относительно исходного уровня выявлено не было.
Фармакокинетика:
Бролуцизумаб вводят непосредственно в стекловидное тело с тем, чтобы он оказывал местное воздействие в тканях глаза.
Всасывание/распределение
После интравитреального введения бролуцизумаба в дозе 6 мг в глаз пациентам с нВМД среднее значение Сmax свободного бролуцизумаба в плазме крови составляло 49,0 нг/мл (диапазон: 8,97-548 нг/мл); при этом Сmax достигалась через 1 день.
Метаболизм/выведение
Бролуцизумаб – это фрагмент моноклонального антитела, поэтому исследований метаболизма лекарственного препарата не проводили. Свободный бролуцизумаб представляет собой одноцепочечный фрагмент антитела и ожидается, что его выведение будет происходить за счет мишень-опосредованного распределения через связывание со свободным эндогенным VEGF, пассивного выведения через почки и метаболизма, опосредованного протеолизом.
После интравитреальных инъекций бролуцизумаб выводился из крови с кажущимся периодом полувыведения, составлявшим 4,3 дня. Приблизительно через 4 недели после введения, системные концентрации у большинства пациентов находились на нижней границе предела количественного определения или ниже (<0,5 нг/мл). При применении бролуцизумаба в виде интравитреальных инъекций каждые 4 недели не наблюдалось накопления препарата в сыворотке крови.
Особые группы пациентов
Пожилые пациенты (65 лет или старше)
В клинических исследованиях HAWK и HARRIER приблизительно 90% (978/1088) пациентов, рандомизированных в группу бролуцизумаба, находились в возрасте ≥65 лет, а приблизительно 60% (648/1088) – в возрасте ≥75 лет. Статистически значимых различий в эффективности и безопасности между подгруппами пациентов разного возраста в этих исследованиях не наблюдалось.
Раса / этническая принадлежность
В исследовании, в котором участвовали 24 пациента европеоидной расы и 26 пациентов-японцев, никаких различий в системной фармакокинетике после интравитреальной инъекции, связанных с этнической принадлежностью, выявлено не было.
Нарушения функции почек
Нарушения функции почек различной степени тяжести (от легких до тяжелых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его системная концентрация определяется не столько скоростью его выведения, сколько скоростью его поступления в кровь из тканей глаза, а также в связи с низкой системной экспозицией свободного бролуцизумаба.
Системный клиренс бролуцизумаба оценивали у пациентов с нВМД, для которых имелись данные по фармакокинетическим параметрам бролуцизумаба в плазме крови и данные по клиренсу креатинина (КК). У пациентов с нарушением функции почек легкой степени (КК = 50-79 мл/мин (n=13)) средние значения системного клиренса бролуцизумаба отличались не более чем на 15% от соответствующих значений у лиц с нормальной функцией почек (КК ≥80 мл/мин (n=25)). У пациентов с нарушением функции почек средней степени (КК = 30-49 мл/мин (n=3)) средние значения системного клиренса бролуцизумаба были ниже, чем у пациентов с нормальной функцией почек, однако число таких пациентов было недостаточным для формирования заключения. Пациенты с нарушением функции почек тяжелой степени (КК <30 мл/мин) в исследованиях не участвовали.
Нарушения функции печени
У пациентов с нарушениями функции печени применение бролуцизумаба не изучалось. Нарушения функции печени различной степени тяжести (от легких до тяжелых) не должны влиять на общую системную экспозицию бролуцизумаба, поскольку его метаболизм происходит за счет протеолиза и не зависит от функции печени.